Опасное формирование рисовым долгоносиком Sitophilus Oryzae мочевой кислоты в зерне
Авторы[править | править код]
Г.А. Закладной, д.б.н., А.В. Яицких
Всероссийский научно-исследовательский институт зерна и продуктов его переработки – филиал ФГБНУ «Федеральный научный центр пищевых систем им. В.М. Горбатова» РАН
Аннотация[править | править код]
Экспериментальными исследованиями установлена зависимость количества мочевой кислоты в зерне пшеницы, накопленной в результате жизнедеятельности рисового долгоносика Sitophilus oryzae, от плотности заселения зерна этим насекомым
Статья[править | править код]
Избыток мочевой кислоты в организме человека приводит к образованию ее солей, откладывающихся в суставах и вызывающих подагру.[1]
Довольно давно было заявлено[2], что мочевая кислота может служить индикатором выделений насекомых в зерне и продуктах его помола. Немногим позднее[3] была определена хорошая корреляция между концентрацией мочевой кислоты и количеством выходных отверстий, оставленных насекомыми в зернах. Анализ мочевой кислоты в различных продуктах, как результат азотного метаболизма насекомых, неоднократно предлагался в качестве альтернативы определению фрагментов насекомых в зерне и зернопродуктах[4][5]. Логично предположить, что содержание мочевой кислоты в зерне должно быть прямым образом связано и с количеством в нем насекомых. В данной статье описаны результаты исследования закономерностей изменения содержания мочевой кислоты в зерне от плотности заражения его рисовым долгоносиком.
Материал и методика[править | править код]
За основу методики анализа мочевой кислоты взяты «Методические указания по обнаружению, идентификации и определению содержания мочевой кислоты в зерне и зернопродуктах № 4072-86».
Использовали хроматограф жидкостный «Стайер» производства АО «Аквилон», Россия, по ТУ 4215-003-18294344 с флуориметрическим детектором и программно-аппаратным комплексом «МультиХром». Предел допускаемого значения относительного среднеквадратического отклонения времени удерживания определяемого компонента – 0,5 % и выходного сигнала по высоте и площади пика – 4 %.
Колонка хроматографическая разделительная «Synergi Hydro-RP», 4 мкм, 250×4,6 мм, «Phenomenex», США. Колонка защитная «C18» или «C18 Aq», 4,0×3,0 мм, «Phenomenex», США. Р
Режим разделения - изократический, подвижная фаза 0,04М ацетатный буфер (рН=5,8), скорость потока 1 см3 /мин, объем петлевого дозатора 20 мкл, температура термостата колонки 30 °C, детектирование флуориметрическое (λex: (282±2) нм, уровень чувствительности детектора RFU: 0,01, ориентировочное время удерживания мочевой кислоты – 5-6 мин.
Градуировку выполняли последовательно для всех растворов. Для каждого градуировочного раствора регистрировали не менее двух хроматограмм.
Полученную хроматограмму обрабатывали в соответствии с руководством пользователя программного обеспечения «МультиХром».
Пики мочевой кислоты идентифицировали по абсолютному времени удерживания.
Рассчитанный для градуировочного графика коэффициент корреляции (R) равен 0,998, случайная составляющая погрешность была 3,14 %.
Навеску зерна 20 г помещали в плоскодонную коническую колбу, добавляли 200 мл дистиллированной воды и кипятили в течение 10 минут. После охлаждения до 25 °С экстракт фильтровали через складчатый бумажный фильтр.
Проводили анализ двух параллельных проб, для каждой из которых выполняли по два измерения с получением двух хроматограмм.
Массовая концентрация мочевой кислоты в пробах, введенных в хроматограф, автоматически рассчитывалась системой сбора и обработки хроматографической информации.
Рассчитывали среднее арифметическое значение двух результатов анализа массовой концентрации мочевой кислоты для каждой из параллельных проб.
Расчет содержания мочевой кислоты в образце зерна (Х, мг/кг) проводили по формуле:
Х, мг/кг = С·V:m ,
где:
V – объем экстракта, мл (200 мл),
m – масса пробы зерна (20 г),
С – среднее значение массовой концентрации мочевой кислоты в пробе, введенной в хроматограф (мкг/мл).
Пробы зерна, пораженные рисовым долгоносиком, готовили следующим образом.
В стеклянные сосуды с сетчатыми крышками помещали зерно пшеницы влажностью 12,2 % в количестве 1,0 кг. Зерно прежде не было заражено насекомыми и клещами и не обрабатывалось пестицидами.
К зерну подсаживали жуков рисового долгоносика без разделения на пол и возраст в количестве 300 экземпляров из многолетней лабораторной культуры.
Сосуд с зерном содержали при относительной влажности воздуха около 75 % и температуре 25 °С. Спустя 35 суток, когда завершилось развитие первых отложенных самками яиц, родителей удаляли, а зерно хранили при температуре минус 11 °С до проведения анализа в нем мочевой кислоты.
Из зерна формировали пробы зерна с разной плотностью загрязненности рисовым долгоносиком, для чего загрязненное зерно разбавляли незагрязненным в различных соотношениях, чтобы получить ряд проб с нарастающим в них количеством загрязненных зерен, соответствующим следующим количеству жуков в экз./кг: 0, 1, 2, 5, 7.5, 10, 15, 20, 30, 39, 78, 155. В зерне этих проб проводили анализ содержания мочевой кислоты.
Результаты и обсуждение[править | править код]
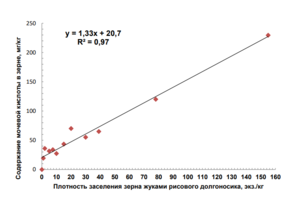
На рис. приводим график зависимости количества мочевой кислоты в зерне пшеницы от плотности заселения зерна жуками рисового долгоносика. Видно, что увеличение количества жуков рисового долгоносика в зерне влечет за собой повышение содержания в нем мочевой кислоты. Зависимость эта описывается уравнением прямой линии при высокой величине коэффициента детерминации, равной 0,97.
Полученные результаты убеждают в возможности установления МДУ мочевой кислоты в зерне, соответствующей имеющимся МДУ плотности заселения зерна насекомыми разных видов.
Контроль содержания в зерне мочевой кислоты позволит обеспечить безопасность зерна по этому показателю, что исключит вывод на рынок фальсифицированной зерновой продукции, например, после удаления насекомых из зерна его сепарированием.
Список литературы[править | править код]
- ↑ Информационный ресурс: https://analiz-diagnostika.ru/krov/bioximiya/+povyshennaya-mochevaya-kislota.html
- ↑ Subrahmanyan, V., Swaminathan, M., Pingale, S. V., and Kadkol, S. B. Uric acid as an index of insect filth in cereals and milled cereal products // Bull. Cent. Food Technol. Res. Inst. Mysore. – 1955. – No. 5. - P. 86.
- ↑ Venkat Rao, S., Nuggehalli, R. N., Pingale, S. V., Swaminathan, M., and Subrahmanyan, V. The relation between the uric acid content and the extent of kernel damaged in insect infested grain // Food Sci. – 1957. – No. 6. – P. 273.
- ↑ Lamkin, W. M., Unruh, N. C., and Pomeranz, Y. Use of fluorometry for the determination of uric acid in grain. Elimination of interfering fluorescence // Cereal Chem. – 1991. – 68. – P. 81.
- ↑ Wehling, R. L., and Wetzel, D. L. High performance liquid chromatographic determination of low level uric acid in grain and cereal products as a measure of insect infestation // J. Chromatogr. – 1983. – 296. – P. 191.